Para ilmuwan berhasil menggunakan sel induk pasien dan bioprinting 3D untuk menghasilkan jaringan mata. Teknik ini diharapkan akan memberikan pemahaman lebih lanjut tentang mekanisme penyakit yang menyebabkan kebutaan.
Para ilmuwan menggunakan sel induk pasien dan bioprinting 3D untuk menghasilkan jaringan mata yang akan memajukan pemahaman tentang mekanisme penyakit yang menyebabkan kebutaan.
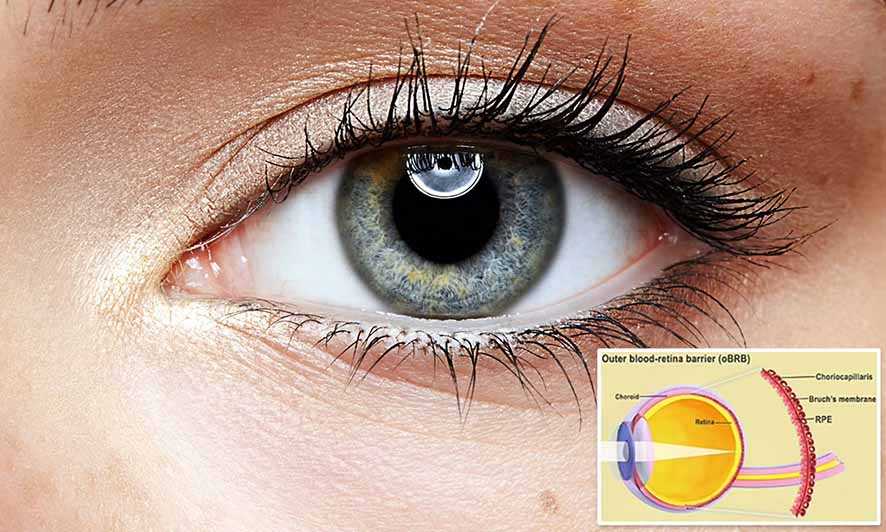
Tim peneliti dari National Eye Institute (NEI), bagian dari National Institutes of Health, berhasil mencetak kombinasi sel yang membentuk penghalang pembuluh darah retina terluar yaitu jaringan mata yang mendukung fotoreseptor penginderaan cahaya retina.
Teknik ini memberikan pasokan jaringan yang berasal dari pasien yang secara teoritis tidak terbatas untuk mempelajari penyakit retina degeneratif seperti degenerasi makula terkait usia (age-related macular degeneration/AMD).
"Kita tahu bahwa AMD dimulai di penghalang pembuluh darah retina terluar," tulis Kapil Bharti PhD, yang mengepalai Riset Translasi Okular dan Sel Punca di NEI, dalam jurnal akademik berjudul Bioprinted 3D outer retina barrier uncovers RPE-dependent choroidal phenotype in advanced macular degeneration yang dipublikasikan Nature Methods pada 22 Desember lalu.
"Namun, mekanisme inisiasi dan perkembangan AMD ke tahap kering dan basah lanjutan masih kurang dipahami karena kurangnya model manusia yang relevan secara fisiologis," imbuh dia.
Penghalang darah-retina bagian luar terdiri dari epitel pigmen retina (RPE), dipisahkan oleh membran Bruch dari choriocapillaris yang kaya akan pembuluh darah. Membran Bruch mengatur pertukaran nutrisi dan limbah antara choriocapillaris dan RPE. Pada AMD, endapan lipoprotein yang disebut drusen terbentuk di luar membran Bruch, menghambat fungsinya. Seiring waktu, kerusakan RPE menyebabkan degenerasi fotoreseptor dan kehilangan penglihatan.
Bharti dan rekan menggabungkan tiga jenis sel koroid yang belum matang dalam hidrogel yaitu pericytes dan sel endotel, yang merupakan komponen kunci dari kapiler; serta fibroblas, yang memberikan struktur jaringan.
Para ilmuwan kemudian mencetak gel pada perancah biodegradable. Dalam beberapa hari, sel mulai matang menjadi jaringan kapiler yang padat. Pada hari kesembilan, para ilmuwan menanam sel epitel pigmen retina di sisi lain perancah. Jaringan yang dicetak mencapai kematangan penuh pada hari ke-42.
Analisis jaringan dan pengujian genetik dan fungsional menunjukkan bahwa jaringan yang dicetak terlihat dan berperilaku serupa dengan penghalang pembuluh darah retina terluar asli. Di bawah tekanan yang diinduksi, jaringan yang dicetak menunjukkan pola AMD awal seperti endapan drusen di bawah RPE dan perkembangan menjadi AMD tahap kering akhir, di mana degradasi jaringan diamati.
Penampilan seperti AMD basah yang diinduksi oksigen rendah, dengan hiperproliferasi pembuluh koroid yang bermigrasi ke zona sub-RPE. Obat anti-VEGF, yang digunakan untuk mengobati AMD, menekan pertumbuhan berlebih dan migrasi pembuluh ini serta memulihkan morfologi jaringan.
"Dengan mencetak sel, kami memfasilitasi pertukaran isyarat seluler yang diperlukan untuk anatomi penghalang pembuluh darah retina terluar yang normal," kata Bharti. "Misalnya, keberadaan sel RPE menginduksi perubahan ekspresi gen pada fibroblas yang berkontribusi pada pembentukan membran Bruch, merupakan sesuatu yang disarankan bertahun-tahun yang lalu tetapi tidak terbukti hingga model kami," papar dia.
Tantangan Teknis
Di antara tantangan teknis yang ditangani oleh tim Bharti adalah menghasilkan perancah yang dapat terurai secara hayati dan mencapai pola pencetakan yang konsisten melalui pengembangan hidrogel yang peka terhadap suhu yang mencapai baris berbeda saat dingin, tetapi larut saat gel dihangatkan.
Serangkaian konsistensi yang sempurna memungkinkan sistem kuantifikasi struktur jaringan yang lebih akurat. Mereka juga mengoptimalkan rasio campuran sel pericytes, sel endotel, dan fibroblas.
Rekan penulis Marc Ferrer PhD, direktur 3D Tissue Bioprinting Laboratory di NIH's National Center for Advancing Translational Sciences, dan timnya memberikan keahliannya untuk biofabrikasi jaringan penghalang pembuluh darah retina terluar secara lebih mendalam bersama dengan pengukuran analitik untuk mengaktifkan skrining obat.
"Upaya kolaboratif kami telah menghasilkan model jaringan retina yang sangat relevan untuk penyakit mata degeneratif," kata Ferrer. "Model jaringan seperti itu memiliki banyak kegunaan potensial dalam aplikasi translasi, termasuk pengembangan terapi," imbuh dia.
Bharti dan kolaborator menggunakan model penghalang pembuluh darah retina cetakan untuk mempelajari AMD, dan mereka bereksperimen dengan menambahkan tipe sel tambahan ke proses pencetakan, seperti sel kekebalan, untuk merekapitulasi jaringan asli dengan lebih baik. ν ils/I-1
"Peta Sel Retina" bagi Terapi Melawan Penyakit Penyebab Kebutaan
Para peneliti telah mengidentifikasi perbedaan nyata di antara sel-sel yang menyusun jaringan di retina yang sangat penting bagi persepsi visual manusia. Para ilmuwan dari National Eye Institute (NEI) menemukan lima subpopulasi epitel pigmen retina (RPE) - lapisan jaringan yang memelihara dan mendukung fotoreseptor penginderaan cahaya retina.
Dengan menggunakan kecerdasan buatan, para peneliti menganalisis gambar RPE pada resolusi sel tunggal untuk membuat "peta" referensi yang menempatkan setiap subpopulasi di dalam mata.
"Hasil ini memberikan kerangka kerja pertama untuk memahami subpopulasi sel RPE yang berbeda dan kerentanannya terhadap penyakit retina, dan untuk mengembangkan terapi bertarget untuk mengobatinya," tulis Michael F Chiang, MD, direktur NEI, bagian dari Institut Kesehatan Nasional, dalam sebuah laporan penelitian berjudul Single-cell-resolution map of human retinal pigment epithelium helps discover subpopulations with differential disease sensitivity yang dipublikasikan oleh jurnal Proceedings of the National Academy of Sciences pada awal Mei lalu.
"Temuan ini akan membantu kami mengembangkan terapi sel dan gen yang lebih tepat untuk penyakit mata degeneratif tertentu," kata peneliti utama studi tersebut, Kapil Bharti, PhD, yang mengepalai Riset Translasi Okular dan Sel Punca di NEI.
Penglihatan dimulai ketika cahaya mengenai fotoreseptor batang dan kerucut yang melapisi retina di bagian belakang mata. Setelah diaktifkan, fotoreseptor mengirimkan sinyal melalui jaringan kompleks neuron retina lain yang bertemu di saraf optik sebelum melakukan perjalanan ke berbagai pusat di otak. RPE berada di bawah fotoreseptor sebagai lapisan tunggal, sedalam satu sel.
Usia dan penyakit dapat menyebabkan perubahan metabolisme pada sel RPE yang dapat menyebabkan degenerasi fotoreseptor. Dampak pada penglihatan dari perubahan RPE ini bervariasi secara dramatis berdasarkan tingkat keparahan dan tempat sel RPE berada di dalam retina.
Misalnya, degenerasi retina onset lambat (L-ORD) mempengaruhi sebagian besar retina perifer dan, oleh karena itu, penglihatan tepi. Degenerasi makula terkait usia (age-related macular degeneration/AMD) merupakan penyebab utama kehilangan penglihatan, terutama memengaruhi sel RPE di makula, yang sangat penting untuk penglihatan sentral.
Bharti dan rekan berusaha untuk menentukan apakah ada subpopulasi RPE yang berbeda yang mungkin menjelaskan spektrum fenotip penyakit retina yang luas.
Tim ilmuwan lalu menggunakan kecerdasan buatan (AI) untuk menganalisis morfometri sel RPE, bentuk luar dan dimensi setiap sel. Mereka melatih komputer menggunakan gambar RPE berlabel berfluoresensi untuk menganalisis seluruh monolayer RPE manusia dari sembilan donor yang telah meninggal dunia tanpa riwayat penyakit mata yang signifikan.
Berdasarkan morfometri, mereka mengidentifikasi lima subpopulasi sel RPE yang berbeda, disebut sebagai P1-P5, diatur dalam lingkaran konsentris di sekitar fovea, yang merupakan pusat makula dan daerah retina yang paling peka terhadap cahaya. Dibandingkan dengan RPE di pinggiran, RPE foveal cenderung berbentuk heksagonal sempurna dan terletak lebih kompak, dengan jumlah sel tetangga yang lebih banyak.
Tanpa diduga, mereka menemukan bahwa retina perifer mengandung cincin sel RPE (P4) dengan area sel yang sangat mirip dengan RPE di dalam dan sekitar makula.
"Kehadiran subpopulasi P4 menyoroti keragaman dalam pinggiran retina, menunjukkan bahwa mungkin ada perbedaan fungsional di antara RPE yang saat ini tidak kita sadari," kata penulis pertama studi tersebut, Davide Ortolan PhD, seorang peneliti di NEI Ocular and Stem Cell Translational Research Section.
"Studi di masa depan diperlukan untuk membantu kita memahami peran subpopulasi ini," ungkap dia. "Secara keseluruhan, hasilnya menunjukkan bahwa AI dapat mendeteksi perubahan morfometri sel RPE sebelum perkembangan degenerasi yang terlihat jelas," imbuh Ortolan.
Perubahan morfometrik terkait usia juga dapat muncul di beberapa subpopulasi RPE sebelum terdeteksi di subpopulasi lain. Temuan ini akan membantu menginformasikan studi masa depan menggunakan teknologi pencitraan non-invasif, seperti optik adaptif, yang menyelesaikan sel retina dengan detail yang belum pernah terjadi sebelumnya dan berpotensi digunakan untuk memprediksi perubahan kesehatan RPE pada pasien yang masih hidup. ils/I-1